eCTD驗證標準的嚴格性與分類:歐盟對eCTD的驗證要求分為“錯誤”“警告”和“提示信息”三級,其中“錯誤”項直接導致申報被拒。驗證項目涵蓋六大類共149條,包括文件命名規范(如路徑長度限制)、PDF可讀性(禁止密碼保護)、XML骨架文件完整性等。例如,文件擴展名必須符合規范(如.xpt用于臨床數據集),而文件夾層級需避免空目錄或混合存放文件。相較于中國《電子申報驗證標準》的簡化版(54條),歐盟的驗證體系更為復雜,體現了其高標準的技術監管。歐盟eCTD注冊外包相關技術支持。浙江國內注冊eCTD業務
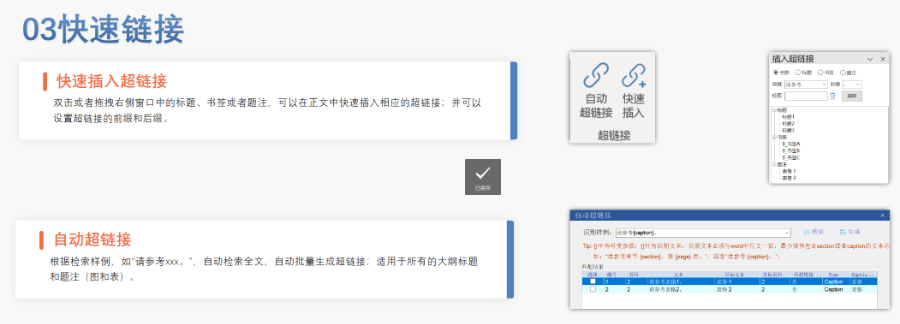
內容與格式檢查Word預處理:需檢查拼寫、縮略語、單位格式(如),設置多級列表自動編號(如),統一字體(宋體/TimesNewRoman)和段落格式。重復內容處理:相同劑型不同規格可共用模塊3,但需區分包裝系統(如、)。外文資料:中文在前、原文在后,參考文獻需中英文對照并建立跨網頁鏈接。使用符合ICH標準的eCTD編輯器自動生成XML骨架和MD5校驗值,拖拽PDF文件構建結構樹。序列管理:序列號從0000開始遞增,每次提交需更新序列,生命周期狀態(New/Replace/Delete)需在XML中明確標注。驗證與遞交:確保無驗證錯誤(如書簽缺失、超鏈接斷鏈),通過ESG等電子通道傳輸,光盤封面需包含申請號和序列號。全生命周期管理版本:通過軟件實現網頁簽入/簽出、審批流程,支持歷史版本追溯。變更管理:增補(Append)和替換(Replace)需關聯原始序列,刪除(Delete)需徹底移除無效文件。 云南原料藥eCTD美國eCTD注冊外包相關技術支持。
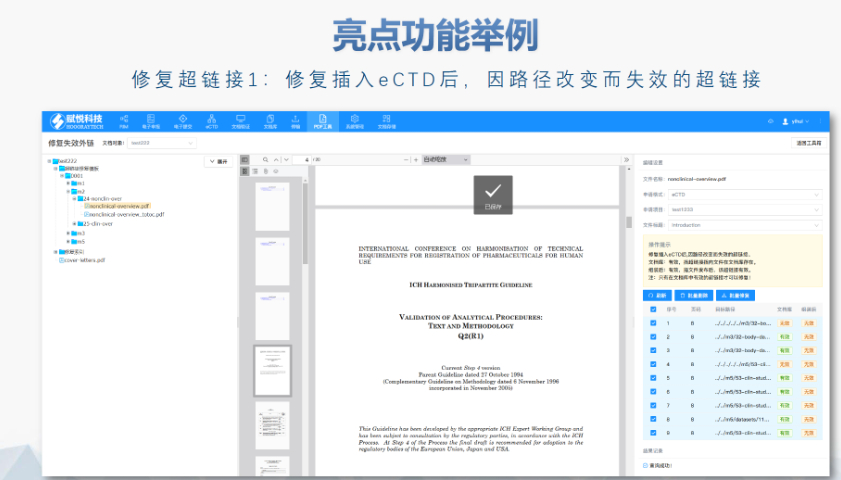
賦悅eCTD系統 文件驗證與修復 支持自動驗證文件格式(如PDF屬性、字體嵌入、超鏈接完整性等),并一鍵修復不符合法規要求的文件。例如,系統會自動檢查XML主干文件的結構合規性,確保符合中國、美國、歐盟等地區的eCTD法規標準。 eCTD組裝與發布 可自動生成符合CTD結構的電子文檔包,包括XML主干文件、文件夾命名規范及序列號管理(如申請號/序列號文件夾自動生成),并支持超鏈接和書簽的批量創建。例如,初次提交的序列號為0000,后續每次提交自動遞增。 生命周期管理 支持文件全生命周期操作(增、增補、替換、刪除),并通過序列號疊加直觀顯示各章節文件的有效性,覆蓋從初次提交到年報、撤市的全流程管理。 協同與權限管理 基于B/S架構(瀏覽器/服務器),支持云端或本地靈活部署,全集團賬號通用。提供多用戶協作功能,包括權限分級、審計追蹤、文件版本控制等。 法規支持與專業服務 內置符合中國CDE、美國FDA、歐盟EMA等法規的模板,同時提供注冊咨詢、資料撰寫、eCTD格式代轉等全流程支持,團隊擁有17年藥品注冊經驗。
歐盟eCTD的歷史沿革與強制實施 歐盟自2003年逐步推進eCTD(電子通用技術文檔)的標準化進程,初要求藥注冊申請(MAA)采用CTD格式。2010年,集中審評程序(CP)率先強制使用eCTD,隨后分散程序(DCP)和互認程序(MRP)分別于2015年、2017年跟進。至2019年,歐盟要求所有國家程序(NP)的注冊申請均以eCTD格式提交,標志著其電子遞交體系的成熟。2024年,EMA啟動eCTD4.0試點項目,旨在提升技術兼容性與審評效率。 eCTD驗證標準的迭代與關鍵更 歐盟的驗證標準歷經多次調整,例如2025年3月啟用的eCTD3.1區域模板和驗證規則v8.1,對文件結構、元數據和內容完整性提出更嚴格的要求。標準引入的“追蹤表(Tracking Table)”強制校驗規則(如15.11和15.12)曾導致CEP(歐洲藥典適用性證書)遞交,后通過允許占位文件臨時解決。與早期版本相比,v8.1強化了對模塊一區域信息的邏輯驗證,并細化了對PDF書簽、超鏈接的規范性檢查。澳大利亞ANDA注冊申報相關技術支持。

澳大利亞的藥品電子通用技術文檔(eCTD)注冊申報體系是澳大利亞y藥品商品管理局(TGA)推動藥品審評現代化的重要舉措。eCTD作為國際通行的電子化注冊申報標準,通過結構化數據格式(如XML)整合了藥品質量、安全性和有效性的技術文檔,實現了從傳統紙質遞交向數字化流程的轉型。根據TGA要求,eCTD需遵循通用技術文檔(CTD)框架,分為五個模塊:模塊1包含澳洲特定的行政信息(如產品說明書草案和GMP證明);模塊2為質量、非臨床及臨床研究的綜述與總結;模塊3至模塊5則分別涵蓋藥學、非臨床和臨床的詳細數據。澳大利亞自2024年起加速推進eCTD實施,要求創新藥注冊申報優先采用該格式,以提升審評效率并支持全球同步申報。 申報流程上,企業需通過TGA指定的電子提交門戶(如eSubmission Gateway)上傳eCTD序列,并在受理后5個工作日內同步提交紙質版模塊1-5資料。澳大利亞的eCTD申報相關技術支持。上海賦悅科技eCTD推薦
加拿大NDA注冊申報相關技術支持。浙江國內注冊eCTD業務
美國于2003年成為全球早采用eCTD(電子通用技術文檔)的國家之一,初由CDER和CBER作為電子提交平臺試點。2008年起,eCTD正式成為藥申請(NDA)和生物制品許可申請(BLA)的標準格式,并在2012年通過《藥申報者付費法案》(PDUFA)進一步強化其法律地位。至2017年,FDA強制要求所有藥申請(NDA)、簡略藥申請(ANDA)及藥物主文件(DMF)必須采用eCTD格式提交,標志著其從可選到強制的轉型。這一進程在2018年擴展至臨床試驗申請(IND),終實現全類型藥品注冊的電子化覆蓋浙江國內注冊eCTD業務